Särläkemedel: en mödosam väg
De som berörs av sällsynta sjukdomar som har inget botemedel look med hopp till särläkemedel, har vissa läkemedel som syftar till en mycket liten population och vars investeringar i forskning och utveckling inte kompensera läkemedelsindustrin om inte för de incitament de får. På World Rare Disease Day, går till forskning, vi går igenom den mödosamma resan av en föräldralös
Läkemedel.
Andra nyheter
- Patienter med ovanliga sjukdomar kräver en statlig fond för sina behandlingar
- Vilka är biologics?
I Spanien, mer än tre miljoner människor lider av några av de mer än 7500 sällsynta sjukdomar eller ultrarraras (de förekommer hos färre än fem av 10000 personer), men endast 6% har en särskild behandling.
Den Föräldralösa Droger. De syftar till att bekämpa dessa sjukdomar. Av 95 som godkändes av den europeiska läkemedelsmyndigheten (EMA) sedan 2002, har 53 sålts hittills i Spanien, i enlighet med den spanska föreningen uppdaterade Laboratorie Orphans och Ultrahuérfanos Drugs data (AELMHU).
Detta partnerskap avspeglar att det finns en nedåtgående trend under de senaste åren: under perioden 2002-2011 om 42 särläkemedel godkänts i Europa, 38 godkändes Spanien (90,5%) under perioden 2012-2015, med 44 godkänts av EMA, endast 13 erhålls grönt ljus i Spanien (29,5%).
Beträffande den tid som förflutit sedan antagandet av EMA till marknadsföring i Spanien tillbringar i genomsnitt tjugo månader.
I denna mening, den spanska federationen för sällsynta sjukdomar (ERUF) säkerställer att ett läkemedel kan ta upp till två år för att nå familjer och det faktum att varje region är konfigurerad som ett fristående system inte alla lika tillgång till dessa läkemedel, så att de hävdar bara kriterier för tillgång och påskynda processen för kommersialisering.
AELMHU, som samlar mer än ett dussin läkemedels- och bioteknikföretag tillägnad utveckla innovativa målinriktade behandlingar för patienter med sällsynta och ultrarraras sjukdomar, en rapport från 2015 säger att ”endast en av mellan 5000 till 10.000 molekyler undersöktes slutligen når marknaden ”och de tillbringar mellan 10 och 12 år sedan syntes av ett läkemedel till marknadsföring.
Den genomsnittliga investeringen för en ny behandling är 1100 miljoner euro.

Stegen i föräldralösa
Droger.
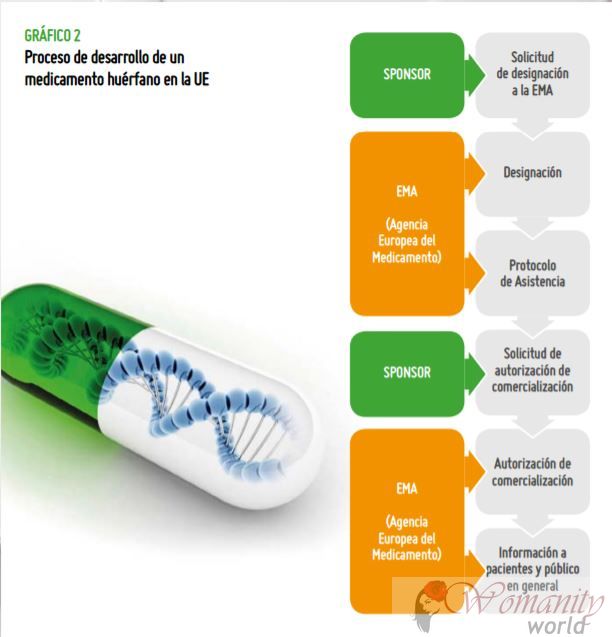
I processen för utveckling av ett särläkemedel finns det två huvudfaser:
1. Beteckning Utförs av både EMA i Europa, och Food and Drug Administration (FDA) i USA. Särläkemedel:Ȏn mödosam väg? Beteckning indikerar att det finns bevis för att detta läkemedel kan vara effektiva som preklinisk testning. I EMA, i detta fall, då de aktiverar stöd eller incitament för att fortsätta den kliniska utvecklingen (tester på patienter)
- Tio års exklusivitet i EU efter godkännandet för försäljning.
- Fri vetenskaplig rådgivning: EMA support på olika undersökningar och prövningar som skall utföras för att visa kvalitet, säkerhet och effekt av läkemedlet.
- Minskning eller upphävande av avgifter i förfarandet.
- Främja forskning: genom finansiering eller EU: s medlemsstater.
2. Godkännande När slutligen läkemedlet visar effekt, kvalitet och säkerhet och är godkänt för marknadsföring.
”Problemet är vad de kallar Death Valley Perioden gått sedan särläkemedelsstatus erhåller tills den når marknaden ”, säger Beatriz Gómez, projektledare vid Centrum för biomedicinsk Network forskning om sällsynta sjukdomar (CIBERER).
Och i detta skede finns vanligen med hindret för att få finansiering, offentlig eller privat, att genomföra kliniska prövningar, som kan pågå i flera år.
Med godkännandet för försäljning är ingen garanti för att i olika stater patienter att få tillgång till läkemedel eftersom processen finansiering och prissättning görs i varje land.
En guide för forskare

CIBERER och den spanska byrån för läkemedel och hälsoprodukter (AEMPS) lanserat en snabbguide för att hjälpa forskare att utveckla särläkemedel avmystifiera komplexiteten i processen.
CIBERER, som främjar och samordnar de olika forskargrupper med sällsynta sjukdomar projekt i hela Spanien, arbetar också för att utveckla nya behandlingsstrategier.
I denna mening har detta forskningscentrum främjas nätverk och sex betecknas som särläkemedel av EMA, tre av dem även utses av FDA.
Dessa tre läkemedel genterapi (teknik som ersätter den muterade genen genom en annan rätt på sällsynta genetiska sjukdomar) och andra 3 är ompositionering läkemedel som redan används för en annan sjukdom, som kan vara användbara för vissa sällsynta sjukdomar. I det senare fallet kostnaden är mindre än



